LA VELOCIDAD DE REACCIÓN
VELOCIDAD DE REACCIÓN:
Cuando consideramos la velocidad de una reacción química nos referimos a cuán rápido ocurre la reacción. Esto se puede pensar en términos de cuán rápido se consumen los reactantes o cuán rápido se forman los productos. La velocidad de reacción es la rapidez con la cual los reactantes se consumen o los productos se forman.
En la figura se muestra una explosión es una reacción muy rápida: se generan gases y gran cantidad de calor muy rápido.Por el contrario, la corrosión es una reacción química muy lenta.
Consideremos la reacción entre el carbonato de calcio y ácido clorhídrico:
CaCO3 (s) + 2HCl (ac) ------>; CaCl2 (ac) + CO2 (g) + H2O (l)
La velocidad de esta reacción puede medirse de varias maneras. Dos de ellas son:
1. Medida de la rapidez con la que se produce CO2.
2. Media de la rapidez con que la masa disminuye.
Medida de la rapidez con la que se produce CO2
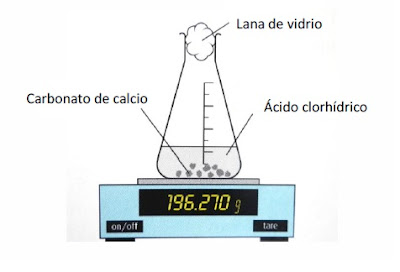
Se monta el aparato como se muestra en la figura sin el carbonato de calcio.
Se remueve el tapón en el matraz erlenmeyer, se añade el carbonato de calcio, se coloca rápidamente el tapón y se empieza a medir el tiempo. Este experimento puede utilizarse para generar un gráfico de volumen de CO2 producido versus tiempo realizando mediciones de volumen cada 10 segundos en la probeta.
A continuación se muestran datos obtenidos en este experimento.
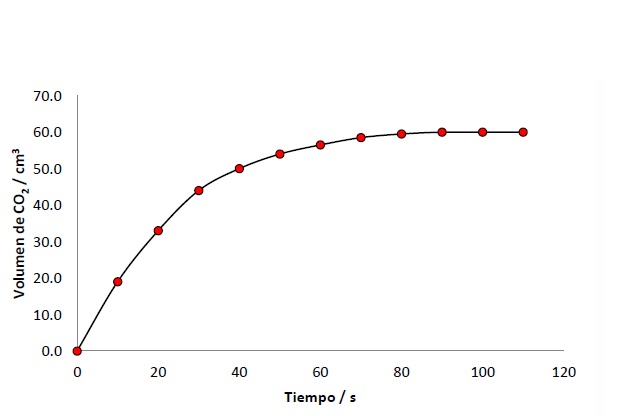
Experimento para medir la rapidez con que se produce CO2 y tabla con los resultados obtenidos
Volumen de CO2 desprendido en función al tiempo de reacción
Resultados del experimento para medir la rapidez con que se produce CO2.
La reacción parece terminar a los 90 segundos, ya que no se forma más gas después de este tiempo. La velocidad de reacción promedio durante los primeros 90 s se puede calcular como sigue:
Velocidad promedio = cambio en el volumen/tiempo = 60,0/90 = 0,67 cm3 s-1
La velocidad en cualquier momento en particular se da por la pendiente del gráfico en ese momento. Esto puede calcularse dibujando la tangente a la curva en ese punto.
La pendiente de la tangente es:
Pendiente = cambio en el volumen/tiempo = 64/30= 2,1 cm3 s-1
Entonces la velocidad de reacción inicial es 2,1 cm3 s-1.
Esto significa que inicialmente se producen 2,1 cm3 de gas por segundo.
A partir de la forma de la gráfica se puede ver que la pendiente disminuye conforme aumenta el tiempo, en otras palabras, la velocidad es mayor al inicio y va disminuyendo. A los 90 s la reacción se detiene y la pendiente de la gráfica es cero.
Se dibuja la tangente en el punto inicial para determinar la velocidad inicial.
Medida de la velocidad con la cual la masa disminuye
La velocidad para esta reacción también se puede determinar midiendo la velocidad en la cual lamasa disminuye. El montaje del experimento se muestra en la figura . La masa disminuye conforme se va liberando CO2. Los datos de esta experiencia se muestran en el gráfico de la figura.
Experimento para medir la velocidad de producción de CO2.
Resultados del experimento para medir la rapidez con que la masa disminuye.
Masa del matraz y su contenido en función del tiempo
Gráfica de los resultados del experimento para medir la rapidez con que disminuye
la masa del matraz y su contenido.
De igual manera, se puede calcular la pérdida de masa de CO2 (196,270 menos masa para cada tiempo) y graficarse en función del tiempo como se muestra en la figura
Masa de CO2 desprendida en función del tiempo
Gráfica de los resultados del experimento en el que se muestra la pérdida de masa de CO2
en función del tiempo.
La velocidad de reacción promedio y la velocidad de reacción inicial pueden calcularse a partir del gráfico, usando las mismas técnicas que en el caso anterior. En este caso tenemos:
Velocidad promedio = cambio en la masa/tiempo = 0,110/90 = 1,2x10-3 g s-1
La velocidad inicial se obtiene dibujando la tangente en el punto inicial y calculando la pendiente. En este caso la velocidad inicial es 4,0x10-3 g s-1.
Las velocidades de reacción pueden determinarse, por ejemplo, siguiendo cambios en el color, pH temperatura, etc. durante la reacción.
Velocidad de reacción
A pesar que las reacciones anteriores se estudiaron teniendo en cuenta cambios de volumen y masa, las velocidades se consideran a menudo en términos de cambios de concentración.
Velocidad de reacción es el cambio en la concentración de reactantes o productos por unidad de tiempo.
Las unidades para velocidad de reacción son mol dm-3 s-1, mol dm-3 min-1, etc. La velocidad promedio en relación a un periodo de tiempo se calcula así:
Velocidad promedio = cambio en la concentración
tiempo
Para la reacción A + B-------->;C, la velocidad en la cual los reactantes se consumen es igual a la velocidad con la que los productos se forman. Por ejemplo, si la velocidad de reacción con respecto a A es 0,12 mol dm-3 s-1, la velocidad de reacción con respecto a C también será 0,12 mol dm-3 s-1.
Sin embargo, para la reacción A-------> 2D, la velocidad a la cual se produce D será el doble de la velocidad a la que se consume A, ya que 1 mol de A producirá 2 moles de D. Entonces si la velocidad de reacción con respecto a A es 0,16 mol dm-3 s-1, la velocidad de reacción con respecto a D será 0,32 mol dm-3 s-1.
La velocidad de reacción se puede calcular en cualquier momento a partir de un gráfico de concentración versus tiempo dibujando la tangente para un tiempo en particular y calculando la pendiente de la tangente, de manera similar a lo mostrado en el gráfico de volumen en función del tiempo en el gráfico de la figura.
Cuando consideramos la velocidad de una reacción química nos referimos a cuán rápido ocurre la reacción. Esto se puede pensar en términos de cuán rápido se consumen los reactantes o cuán rápido se forman los productos. La velocidad de reacción es la rapidez con la cual los reactantes se consumen o los productos se forman.
En la figura se muestra una explosión es una reacción muy rápida: se generan gases y gran cantidad de calor muy rápido.Por el contrario, la corrosión es una reacción química muy lenta.
EXPERIMENTOS PARA MEDIR LA VELOCIDAD DE REACCION
Consideremos la reacción entre el carbonato de calcio y ácido clorhídrico:
CaCO3 (s) + 2HCl (ac) ------>; CaCl2 (ac) + CO2 (g) + H2O (l)
La velocidad de esta reacción puede medirse de varias maneras. Dos de ellas son:
1. Medida de la rapidez con la que se produce CO2.
2. Media de la rapidez con que la masa disminuye.
Medida de la rapidez con la que se produce CO2
Se monta el aparato como se muestra en la figura sin el carbonato de calcio.
Se remueve el tapón en el matraz erlenmeyer, se añade el carbonato de calcio, se coloca rápidamente el tapón y se empieza a medir el tiempo. Este experimento puede utilizarse para generar un gráfico de volumen de CO2 producido versus tiempo realizando mediciones de volumen cada 10 segundos en la probeta.
A continuación se muestran datos obtenidos en este experimento.
Experimento para medir la rapidez con que se produce CO2 y tabla con los resultados obtenidos
Volumen de CO2 desprendido en función al tiempo de reacción
Resultados del experimento para medir la rapidez con que se produce CO2.
La reacción parece terminar a los 90 segundos, ya que no se forma más gas después de este tiempo. La velocidad de reacción promedio durante los primeros 90 s se puede calcular como sigue:
Velocidad promedio = cambio en el volumen/tiempo = 60,0/90 = 0,67 cm3 s-1
La velocidad en cualquier momento en particular se da por la pendiente del gráfico en ese momento. Esto puede calcularse dibujando la tangente a la curva en ese punto.
La pendiente de la tangente es:
Pendiente = cambio en el volumen/tiempo = 64/30= 2,1 cm3 s-1
Entonces la velocidad de reacción inicial es 2,1 cm3 s-1.
Esto significa que inicialmente se producen 2,1 cm3 de gas por segundo.
A partir de la forma de la gráfica se puede ver que la pendiente disminuye conforme aumenta el tiempo, en otras palabras, la velocidad es mayor al inicio y va disminuyendo. A los 90 s la reacción se detiene y la pendiente de la gráfica es cero.
Se dibuja la tangente en el punto inicial para determinar la velocidad inicial.
Medida de la velocidad con la cual la masa disminuye
La velocidad para esta reacción también se puede determinar midiendo la velocidad en la cual lamasa disminuye. El montaje del experimento se muestra en la figura . La masa disminuye conforme se va liberando CO2. Los datos de esta experiencia se muestran en el gráfico de la figura.
Experimento para medir la velocidad de producción de CO2.
Resultados del experimento para medir la rapidez con que la masa disminuye.
Masa del matraz y su contenido en función del tiempo
Gráfica de los resultados del experimento para medir la rapidez con que disminuye
la masa del matraz y su contenido.
De igual manera, se puede calcular la pérdida de masa de CO2 (196,270 menos masa para cada tiempo) y graficarse en función del tiempo como se muestra en la figura
Masa de CO2 desprendida en función del tiempo
Gráfica de los resultados del experimento en el que se muestra la pérdida de masa de CO2
en función del tiempo.
La velocidad de reacción promedio y la velocidad de reacción inicial pueden calcularse a partir del gráfico, usando las mismas técnicas que en el caso anterior. En este caso tenemos:
Velocidad promedio = cambio en la masa/tiempo = 0,110/90 = 1,2x10-3 g s-1
La velocidad inicial se obtiene dibujando la tangente en el punto inicial y calculando la pendiente. En este caso la velocidad inicial es 4,0x10-3 g s-1.
Las velocidades de reacción pueden determinarse, por ejemplo, siguiendo cambios en el color, pH temperatura, etc. durante la reacción.
Velocidad de reacción
A pesar que las reacciones anteriores se estudiaron teniendo en cuenta cambios de volumen y masa, las velocidades se consideran a menudo en términos de cambios de concentración.
Velocidad de reacción es el cambio en la concentración de reactantes o productos por unidad de tiempo.
Velocidad promedio = cambio en la concentración
tiempo
Para la reacción A + B-------->;C, la velocidad en la cual los reactantes se consumen es igual a la velocidad con la que los productos se forman. Por ejemplo, si la velocidad de reacción con respecto a A es 0,12 mol dm-3 s-1, la velocidad de reacción con respecto a C también será 0,12 mol dm-3 s-1.
Sin embargo, para la reacción A-------> 2D, la velocidad a la cual se produce D será el doble de la velocidad a la que se consume A, ya que 1 mol de A producirá 2 moles de D. Entonces si la velocidad de reacción con respecto a A es 0,16 mol dm-3 s-1, la velocidad de reacción con respecto a D será 0,32 mol dm-3 s-1.
La velocidad de reacción se puede calcular en cualquier momento a partir de un gráfico de concentración versus tiempo dibujando la tangente para un tiempo en particular y calculando la pendiente de la tangente, de manera similar a lo mostrado en el gráfico de volumen en función del tiempo en el gráfico de la figura.








Comentarios